Aspects anatomopathologiques des effets rencontrés pendant l’immunothérapie
L’immunothérapie est principalement basée sur l’utilisation d’inhibiteurs de checkpoints de l’immunité (ICI) qui induisent une rupture de la tolérance tumorale et restaurent la réponse immune antitumorale. Cependant, ils peuvent également entraîner une rupture de la tolérance immune dans d’autres tissus provoquant l’apparition d’effets secondaires qui leurs sont propres, appelés évènements indésirables immunologiques (IrAE pour Immune related Adverse Events). Les plus fréquents touchent la peau, le tube digestif, le système endocrine et le foie. Ils sont généralement de grade faible à modéré et peuvent survenir à tout moment, pendant ou après le traitement 1.

Sommaire
Mécanismes biologiques induits par les ICI
Si les effets bénéfiques des ICI sont bien connus et démontrés, ils induisent également un certain nombre d’effets secondaires. Les mécanismes de ces IrAE sont multiples et encore mal connus mais ils joueraient un rôle dans l’homéostase immunologique.
Des études translationnelles menées sur des patients présentant des IrAE ont révélé une augmentation de la réactivité des lymphocytes T effecteurs contre des antigènes présents à la fois sur la tumeur mais également sur les tissus sains (accompagnée d’une déplétion des lymphocytes T régulateurs). Elles ont également permis de constater une augmentation du taux d’autres anticorps préexistants, une élévation du niveau des cytokines inflammatoires et un potentiel rôle du complément 1 [Figure 1]. La composition du microbiote intestinal interviendrait aussi de façon importante dans la survenue ou non des complications, digestives en particulier.
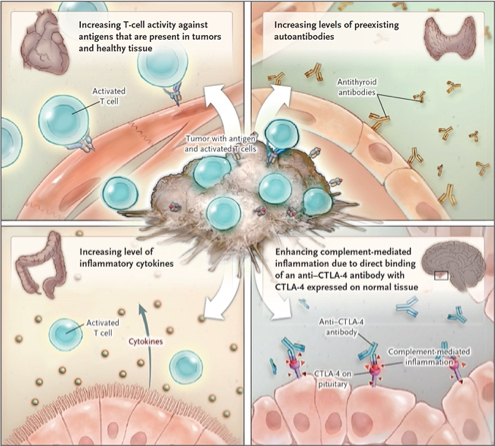
[Figure 1]
Potentiels mécanismes d’action des ICI
Pendant la réponse immune, CTLA-4 inhiberait l’activation des lymphocytes T de manière précoce alors que PD-1 agirait plus tardivement, au niveau des tissus périphériques. Cette différence d’action se reflète ensuite dans les effets secondaires observés, selon le type d’ICI utilisé, qui apparaissent à des fréquences et des moments différents. Cependant, il est important de préciser qu’une durée prolongée du traitement n’impliquera pas une incidence plus importante de ces IrAE.
Principaux évènements indésirables immunologiques (IrAE)
Atteintes digestives
Les atteintes digestives sont parmi les plus fréquentes, en particulier sous anti-CTLA-4 ou traitement combiné 1. Elles peuvent atteindre toutes les parties du système digestif.
Selon le type d’ICI utilisé, les lésions observées seront légèrement différentes 2-6 :
- Lésions de colites aiguës actives à polynucléaires neutrophiles avec une atteinte focale ou diffuse et éventuellement une iléite associée ;
- Colites microscopiques, lymphocytaires et à collagène, qui peuvent être associées à des lésions de colites actives (surtout sous anti-PD-1/PD-L1) ;
- Colites granulomateuses (surtout sous anti-CTLA-4) ;
- Signes de chronicité de plus en plus décrits, caractérisés par un certain degré de distorsion des cryptes, un infiltrat lymphoplasmocytaire basal, une augmentation des cellules de Paneth.
Les lésions histologiques des colites aiguës actives associent un infiltrat inflammatoire polymorphe du chorion, des ulcérations/érosions du revêtement de surface, des exocytoses à polynucléaires neutrophiles responsables de lésions d’abcès cryptiques et éventuellement des granulomes épithélioïdes 2. En immunomarquage, l’infiltrat immun est majoritairement constitué de cellules CD8+ et de Treg+ (sous anti-PD-1/PDL-1) et de CD4+ (sous anti-CTLA-4).
En cas de colites microscopiques lymphocytaires, l’infiltration lymphocytaire intra-épithéliale touche le revêtement de surface mais aussi les cryptes 3, 5.
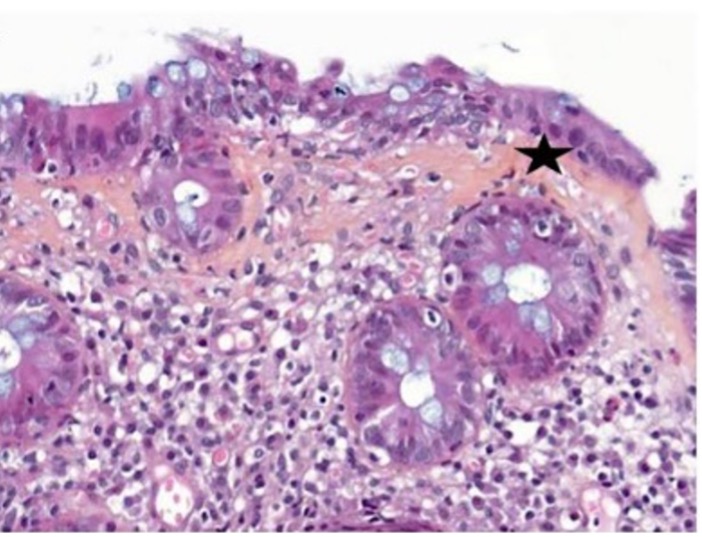
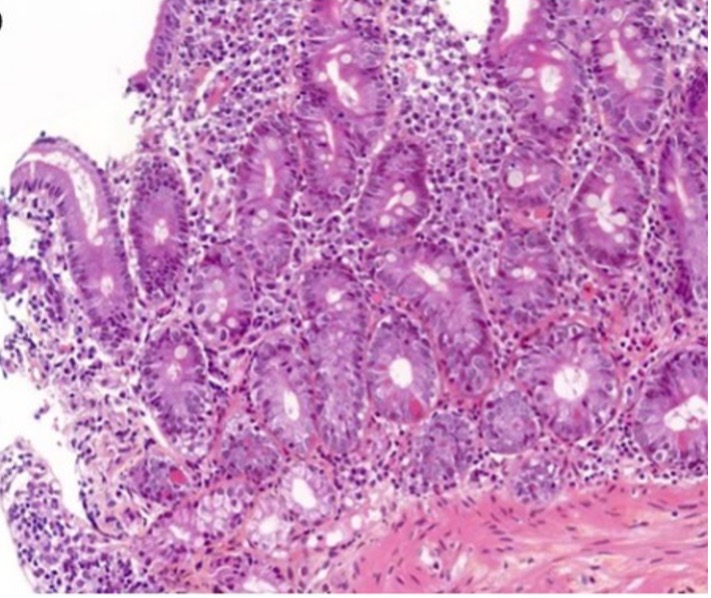
[Figure 2]
Histologies de colites aiguës actives
Le niveau des atteintes digestives hautes est plus difficile à définir car celles-ci sont beaucoup moins symptomatiques que les atteintes colites et ne sont pas systématiquement endoscopées et biopsiées. Schématiquement, les lésions observées sont celles d’une gastrite active à polynucléaires neutrophiles Helicobacter pilori négatives (HP-), voire des lésions gastrites nécrosantes. Il a pu également être observé des gastrites lymphoplasmocytaires avec un infiltrat lymphocytaire organisé autour des collets des glandes et un infiltrat plasmocytaire du reste du chorion. Enfin, des gastrites granulomateuses ont été observées spécifiquement sous anti-CTLA-4. Les lésions duodénales sont superposables avec, en outre, des aspects de duodénites lymphoplasmocytaires 2,4,6.
Malgré ce tableau d’IrAE, établir un diagnostic différentiel peut s’avérer très compliqué car la présence d’un autre traitement ou d’une autre maladie peut causer les mêmes atteintes digestives.
Atteintes hépatiques
Les atteintes hépatiques ont une fréquence moindre que les atteintes colites. Les complications hépatiques sont assez rares et leur incidence diffère selon la nature hépatocellulaire ou non hépatique de la tumeur primitive. Elles sont généralement associées à des IrAE dans d’autres organes 7.
Comme dans le colon, elles diffèrent en fonction du type d’ICI. Dans tous les cas, une hépatite lobulaire avec une nécrose ponctuée est observée [Figure 3]. Les hépatites avec nécrose confluente centro-lobulaire ou pan-lobulaire sont plutôt observées sous anti-CTLA-4. C’est également le cas des hépatites microgranulomateuses et des granulomes à anneau de fibrine.
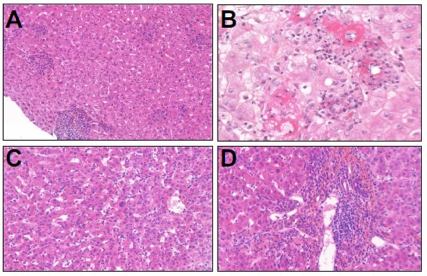
[Figure 3]
Hépatites lobulaires observées chez des patients traités par anti-CTLA-4 et/ou anti-PD-1
A. Hépatite microgranulomateuse (HES x120)
B. Hépatite avec des granulomes à anneau de fibrine (HES x370)
C. Hépatite lobulaire non granulomateuse (HES x190)
D. Hépatite portale et lobulaire avec endothélite (HES x190)
Comme illustré par la figure 3, les hépatites lobulaires présentent une nécrose ponctuée, un infiltrat lymphocytaire et histiocytaire, surtout intrasinusoïdal, et un infiltrat portal avec une discrète activité périportale et une endothélite veineuse portale. Pas ou peu de plasmocytes. Elles ne ressemblent pas à des hépatites auto-immunes et sont composées principalement de lymphocytes CD8+ CD4+.
Les atteintes biliaires sont essentiellement des cholangites lymphocytaires ou à polynucléaires neutrophiles (PNN). Elles touchent plus particulièrement les petits canaux intra-hépatiques et sont potentiellement destructrices. Elles peuvent donc se compliquer de ductopénies et être associées à un aspect de prolifération cholangiolaire, avec cholangiolite. L’atteinte des canaux biliaires de grand calibre est plus rare, caractérisée par un épaississement fibreux de la paroi des canaux biliaires avec un infiltrat riche en lymphocytes CD8+ 7-10. Qu’il s’agisse d’une atteinte des petits canaux (cholangite lymphocytaire/PNN) ou d’une atteinte des gros canaux biliaires, ces IrAE sont spécifiques des anti-PD-1/PD-L1. Des atteintes vasculaires sont également possibles [Figure 4].
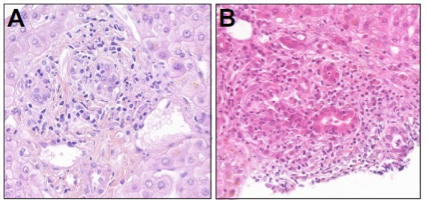
[Figure 4]
Images histologiques d’atteintes biliaires
A. Cholangite destructrice (HES x400)
B. Cholangite granulomateuse (HES x300)
Lésions cutanées
Ces IrAE font partie des toxicités les plus fréquentes. Ils apparaissent dans plus d’un tier des cas quel que soit le cancer traité. Souvent les premiers à apparaitre, ils ne semblent pas dépendants de la dose d’ICI administrée.
Le rash maculopapuleux constitue l’un des IrAE cutané fréquemment observé. L’aspect histopathologique le plus fréquent est eczématiforme avec une dermatose spongiotique, une exocytose lymphocytaire, un infiltrat périvasculaire T superficiel et quelques éosinophiles [Figure 5].
Il faut être vigilant car ce rash peut parfois constituer la phase débutante d’une dermatose plus spécifique (de type psoriasis, dermatose lichénoïde, Grover, pemphigoïde bulleuse) ou d’une dermatose grave (comme les décollements épidermiques vus dans le syndrome de Stevens-Johnson ou une nécrolyse épidermique toxique (Lyell)). Ainsi, une biopsie cutanée est préconisée si les lésions sont cliniquement atypiques ou persistantes/récurrentes, de grade 3 11-16.
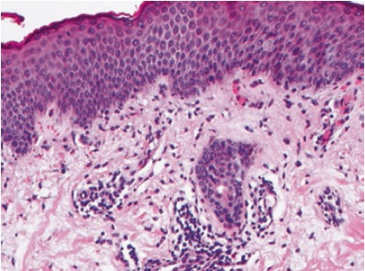
[Figure 5]
Exemple de rash maculopapuleux présentant une dermatite eczémaspongiotique avec des éosinophiles dermiques
Un autre effet indésirable cutané fréquent est le vitiligo [Figure 6]. Il peut s’accompagner d’une dépigmentation des phanères. Il ne se voit que chez des patients atteints d’un mélanome, surtout traités par un anti-PD-1, et il persiste à l’arrêt du traitement. Cette disparition des mélanocytes pourrait s’expliquer par une réponse T cytotoxique contre des épitopes spécifiques qui seraient partagés par la peau normale et par le mélanome (comme MART-1, GP100, tyrosinase…). Plusieurs études rapportent que son apparition est corrélée à une réponse objective et à une survie globale prolongée ce qui pourrait en faire un marqueur indirect de réponse thérapeutique 11-16.
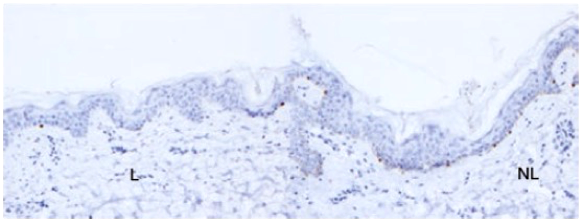
[Figure 6]
Exemple de vitiligo.
Immunomarquage vitiligo-MART1 dans la peau lésionnelle (L) montrant une diminution des mélanocytes à la jonction dermo-épidermique comparé à l’immunomarquage MART1 de la peau non lésionnelle (NL)
Moins fréquemment, des dermatoses lichénoïdes peuvent apparaître, surtout sous anti-PD-1/PDL-1. En histologie, on observe un aspect de toxidermie lichénoïde de type lichen-like avec un infiltrat inflammatoire lymphocytaire qui vient agresser la basale épidermique, mettant en évidence des nécroses kératinocytaires qui ne sont pas confluentes. Un aspect de syndrome de Steven Johnson ou de Lyell toxique, avec des nécroses kératinocytaires qui vont devenir confluentes et aboutir à une nécrose complète de toute la hauteur épidermique, peut parfois être rencontré, mettant en jeu le pronostic vital.
La dermatose bulleuse auto-immune est un effet secondaire peu fréquent qui peut être déclenchée ou bien exacerbée. Un aspect classique de pemphigoïde bulleuse, avec un décollement bulleux sous-épidermique et de nombreux polynucléaires éosinophiles dans et sous la bulle, sera alors observé.
Des pathologies beaucoup plus rares peuvent également apparaître sous ICI, comme un psoriasis (de novo ou exacerbation d’un préexistant) ou toute autre pathologie cutanée préexistante. Ces effets indésirables sont le plus souvent limités, faciles à gérer par les cliniciens (assez peu de grades 3 ou +) et apparaissent précocement.
Lésions broncho-pulmonaires
Des lésions broncho-pulmonaires sont rapportées dans 3-5 % des essais cliniques et 10-20 % en situation de « vraie vie ». Ils ne sont pas les plus fréquents mais sont potentiellement graves voir fatals avec des tableaux de détresse respiratoire aigüe. Ils sont plus fréquents et plus graves chez les patients traités pour CBNPC que pour d’autres types de cancers. Ils apparaissent généralement dans les 3 premiers mois qui suivent l’initiation du traitement, mais cela peut être parfois beaucoup plus tard (plus de 12 mois) voire même après arrêt du traitement 17,18.
Plusieurs types d’atteintes différentes peuvent être observées 17-21. Les lésions les plus fréquentes sont les lésions de pneumopathie organisée. Ces atteintes parenchymateuses diffuses correspondent à des bourgeons fibroblastiques jeunes, œdémateux, endo-alvéolaires. Elles ne sont pas spécifiques d’une étiologie mais présentent la caractéristique d’être très cortico-sensibles.
L’aspect le plus fréquemment décrit est un infiltrat inflammatoire interstitiel, le plus souvent lymphocytaire, mais pouvant également comporter un certain nombre de polynucléaires éosinophiles. Cet infiltrat est, de façon non-exceptionnelle, accompagné de petits granulomes épithélioïdes gigantocellulaires non nécrotiques (parfois seulement des ébauches de granulomes) semblables aux lésions décrites dans les pneumopathies d’hypersensibilités.
Les lésions les moins fréquentes mais associées aux IrAE les plus graves ont des aspects d’œdème aigu du poumon avec une clinique de détresse respiratoire aigüe. Ces formes présentent une histopathologie :
- de dommages alvéolaires diffus (DAD, Diffuse Alveolar Damage) se traduisant par la présence de membranes hyalines adhérentes à des alvéoles dénudées modérément inflammatoires ;
- d’alvéolites fibrineuses à rapprocher d’une pneumonie aiguë fibrineuse et organisée (AFOP, Acute Fibrinous and Organizing Pneumonia) se traduisant par la présence de boules de fibrines en O alvéolaire.
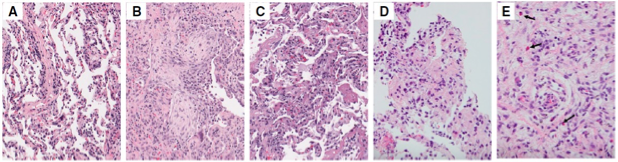
[Figure 7]
Patterns histologiques de pneumonies organisées observées sur biopsies pulmonaires en H&E
(X200 pour A, B et C, X400 pour D et E)
A. Pneumopathies interstitielle cellulaire (cas bénin illustré)
B. Pneumonie organisée
C. Lésions alvéolaires diffuses
Observations possibles d’ébauches de granulomes D. et d’éosinophiles E. (flèches)
Enfin, des atteintes beaucoup plus rares peuvent apparaître associées aux atteintes parenchymateuses diffuses. Il s’agit d’adénopathies médiastino-hilaires « sarcoïdose-like ».
Aucun de ces patterns n’est spécifique. Il faut donc toujours envisager les diagnostics différentiels avec une corrélation anatomo-radio-clinique (risque infectieux important, progression tumorale potentielle, ou autres pneumopathies interstitielles).
Discussion et conclusions
Le blocage des points de contrôle immunitaires constitue une stratégie de traitement anticancéreux de plus en plus fréquente. Les évènements indésirables d’origine immunologiques (IrAE) résultent d’une immunité excessive contre les organes normaux. Aucune explication claire n’a permis à ce jour de déterminer pourquoi certains patients développent de sérieux IrAE et d’autres pas. Une prédisposition génétique ou une composition particulière de la flore gastrointestinale sont des pistes actuellement à l’étude. Le large éventail de potentiels évènements indésirables nécessite une prise en charge multidisciplinaire et collaborative de tous les acteurs cliniques et anatomopathologiques afin de prendre au mieux en charge ces patients.
Le clinicien, en concertation avec le pathologiste, pourra ainsi décider de la meilleure suite à donner au traitement du patient si l’effet indésirable apparu est :
- Une toxicité de l’immunothérapie. Selon le degré de gravité de l’IrAE et si celui-ci est bien causé par l’ICI, le clinicien pourra décider d’arrêter le traitement, de le suspendre ou de donner un traitement complémentaire approprié.
- Une progression de la maladie (métastases), une infection ou une réactivation d’une maladie préexistante.
Il a été avancé la théorie que certains effets secondaires seraient un signe de bonne réponse aux ICI, de bonne réactivation immunitaire. Cependant, la corrélation entre activation immunologique et immunité antitumorale reste encore controversée. Certaines études suggèrent que les patients présentant des IrAE ont des taux de réponse plus élevés que les patients sans aucun évènement indésirable mais ces résultats n’ont pas encore pu être généralisés 22,23.
Références
(1) Postow MA, Sidlow R, Hellmann M. Immune-related adverse events associated with immune checkpoint blockade. New Eng J Med, 2018; 378:158-68.
(2) Collins M, Michot JM, Danlox FX, Mussini C, Soularue E, Mateus C, et al. Inflammatory gastrointestinal diseases associated with PD-1 blockade antibodies. Ann Oncol, 2017.
(3) Reddy HG, Schneider BJ, Tai AW. Immune checkpoint inhibitor-associated colitis and hepatitis. Clin Transl Gastroenterol, 2018.
(4) Som A, Mandaliya R, Alsaadi D, Farshidpour M, Charabaty A, Malhotra N, Mattar MC. Immune checkpoint inhibitor-induced colitis: A comprehensive review. World J Clin Cos, 2019.
(5) Yoshino K, Nakayama T, Ito A, Sato E, Kitano S. Severe colitis after PD-1 blockade in advance melanoma patients: potential role of Th1-dominant immune response in immune-related adverse events: two case reports. BMC Cancer, 2019.
(6) Zhang ML, Neyaz A, Patil D, Chen J, Dougan M, Deshpande V. Immune-related adverse events in the gastrointestinal tract: diagnostic utility of upper gastrointestinal biopsies. Histopathology, 2020.
(7) De Martin E, Michot JM, Rosmorduc O, Guettier C, Samuel D. Liver toxicity as a limiting factor to the increasing use of immune checkpoint inhibitors. JHED Reports. 2020.
(8) LoPiccolo J, Brener MI, Oshima K, Lipson EJ, Hamilton JP. Nodular regenerative hyperplasia associated with immune checkpoint blockade. Hepatology, 2018.
(9) Papouin B, Mussini C, De Martin E, Guettier C. Hepatic and digestive adverse events of immune checkpoint inhibitors (anti-CTLA-4 and, anti-PD-1/PD-L1): a clinic-pathological review. Ann Pathol, 2018.
(10) Peeraphatdit TB, Wang J, Odenwald MA, Hu S, Hart J, Charlton MR. Hepatotoxicity from immune checkpoint inhibitors: a systematic review and management recommendation. Hepatology, 2020.
(11) Phillips GS, Wu J, Hellmann MD, Postow MA, Rizvi NA, Freites-Martinez A, Chan D, et al. Treatment outcomes of immune-related cutaneous adverse events. J Clin Oncol. 2019.
(12) Chan L, Hwang SJE, Byth K, Kyaw M, Carlino MS, Chou S, Fernandez-Penas P. Survival and prognosis of individuals receiving programmed cell death 1 inhibitor with and without immunologic cutaneous adverse events. J Am Acad Dermatol. 2020.
(13) Patel AB, Pacha O. Skin reactions to immune checkpoint inhibitors. Immunotherapy. 2018.
(14) Siegel J, Totonchy M, Damsky W, Berk-Krauss J, Castiglione F, Sznol M, et al. Bullous disorders associated with anti-PD-1 and anti-PD-L1 therapy: a retrospective analysis evaluating the clinical and histopathologic features, frequency, and impact on cancer therapy. J Am Acad Dermatol 2018.
(15) Geisler AN, Phillips GS, Barrios DM, Wu J, Leung DYM, Moy AP, et al. Immune checkpoint inhibitor-related dermatologic adverse events. J Am Acad Dermatol, 2020.
(16) Sibaud V. Dermatologic reactions to immune checkpoint inhibitors. Am J Clin Dermatol. 2018,19:345-361.
(17) Cadranel J, Canellas A, Matton L, Darrason M, Parrot A, Naccache JM, et al. Pulmonary complications of immune checkpoint inhibitors in patients with nonsmall cell lung cancer. Eur Respir Rev, 2019;28(153):190058.
(18) Suresh K, Naidoo J, Ting Lin C, Danoff S. Immune checkpoint immunotherapy for non-small cell lung cancer: benefits and pulmonary toxicities. CHEST, 2018;154(6):1416-1423.
(19) Naidoo J, Wang X, Woo KM, Iyriboz T, Halpenny D, Cunningham J, et al. Pneumonitis in patients treated with anti-programmed death-1/programmed death ligand 1 therapy. J Clin Oncol, 2017;35(7):709-171.
(20) Larsen BT, Chae JM, Dixit AS, Hartman TE, Peikert T, Roden AC. Clinical and histopathologic features of immune checkpoint inhibitor-related pneumonitis. Am J Surg Pathol, 2019;43(10):1331-1340.
(21) Delauney M, Cadranel J, Lusque A, Meyer N, Gounant V, Moro-Sibilot D, et al. Immune-checkpoint inhibitors associated with interstitial lung disease in cancer patients. Eur Respir J, 2017;50(2):1700050.
(22) Attia P, Phan GQ, Maker AV, et al. Autoimmunity correlates with tumor regression in patients with metastatic melanoma treated with anti-cytotoxic T-lymphocyte antigen-4. J Clin Oncol 2005; 23: 6043-53.
(23) Downey SG, Klapper JA, Smith FO, et al. Prognostic factors related to clinical response in patients with metastatic melanoma treated by CTL-associated antigen-4 blockade. Clin Cancer Res 2007; 13: 6681-8.