Posologie
POSOLOGIE (1) CHEZ L’ADULTE dans le traitement des Pneumonies nosocomiales (PN), dont les pneumonies acquises sous ventilation mécanique (PAVM)
ZERBAXA® est administré en perfusion intraveineuse.
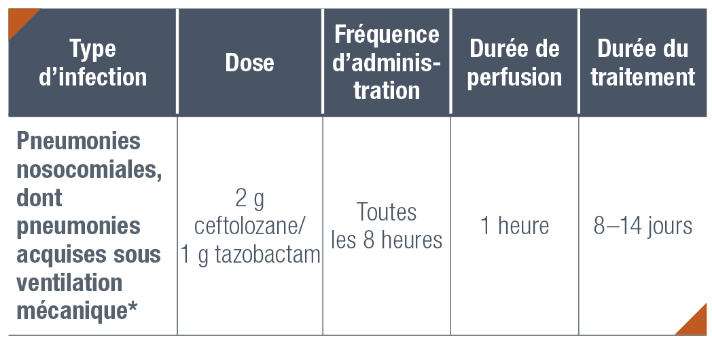
La dose recommandée de ZERBAXA® dans le traitement des pneumonies nosocomiales (dont pneumonies acquises sous ventilation mécanique) est de 2 g ceftolozane/1 g tazobactam administrée toutes les 8 heures en perfusion IV pendant 1 heure chez les patients adultes présentant une clairance de la créatinine supérieure à 50 mL/min.
Comme ZERBAXA® est éliminé par les reins, un ajustement de dose est nécessaire pour les patients dont la clairance de la créatinine est < 50 mL/min comme indiqué ci-dessous.
Chez les patients présentant une insuffisance rénale modérée ou sévère et chez les patients atteints d’insuffisance rénale terminale sous hémodialyse, la posologie doit être adaptée.

Aucun ajustement de la dose n’est nécessaire chez les populations particulières suivantes : personnes âgées (≥ 65 ans), insuffisance hépatique. La dose standard peut être utilisée. Aucune adaptation posologique n’est recommandée en fonction du sexe. Aucune adaptation posologique n’est recommandée en fonction du groupe ethnique.
Population pédiatrique : la sécurité et l’efficacité du ceftolozane/tazobactam chez les enfants et adolescents âgés de moins de 18 ans n’ont pas encore été établies. Aucune donnée n’est disponible.
Préparation et administration(1)
ZERBAXA® se présente sous la forme d’une poudre compacte lyophilisée contenue dans un flacon à usage unique, destiné à reconstituer une solution pour perfusion. (1)
Chaque flacon contient du sulfate de ceftolozane équivalent à 1 g de ceftolozane et du tazobactam sodique équivalent à 0,5 g de tazobactam.
Préparation de la solution pour perfusion

Mode d’administration
ZERBAXA® est administré en perfusion intraveineuse. La durée de perfusion est d’une heure pour 2 g/1 g de ZERBAXA® dans la pneumonie nosocomiale.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la règlementation en vigueur. La solution pour perfusion de ZERBAXA® est limpide et incolore à légèrement jaune. Les variations de couleur dans cette gamme n’affectent pas l’activité du produit.
ATTENTION : LA SOLUTION RECONSTITUÉE NE DOIT PAS ÊTRE INJECTÉE DIRECTEMENT.
Après reconstitution et dilution, la stabilité physico-chimique a été démontrée pendant 4 jours entre 2 et 8°C. Le médicament est photosensible et doit être protégé de la lumière lorsqu’il n’est pas conservé dans le carton d’origine. Du point de vue microbiologique, le médicament doit être utilisé immédiatement après reconstitution. S’il n’est pas utilisé immédiatement, les durées et conditions de conservation après reconstitution/dilution et avant utilisation relèvent de la seule responsabilité de l’utilisateur, sauf si la reconstitution/dilution a été effectuée en conditions aseptiques contrôlées et validées et ne devraient pas dépasser 24 heures entre 2 et 8°C.
En cas d’ajustement de dose pour les patients avec une insuffisance rénale


