Nanomédecine, nanomédicaments et nanoparticules pour la santé de demain
Qu’est-ce que la nanomédecine ?
C’est au début du XXe siècle que la notion de thérapie ciblée a été théorisée par le scientifique allemand Paul Ehrlich avec l’idée du « magic bullet » ou « balle magique » qui permettrait de cibler spécifiquement des agents infectieux au sein de l’organisme sans endommager les cellules de l’hôte1,2. Une idée presque utopique au XXe siècle qui est désormais possible grâce au développement des nanotechnologies.

Mais quand on parle de nanomédecine, de quoi s’agit-il exactement ?
La nanomédecine fait intervenir la nanotechnologie au service de la médecine pour rendre la prise en charge des maladies plus précise et plus adaptée. Des matériaux à l’échelle du nanomètre (10-9 m) permettent d’agir directement au niveau des mécanismes du vivant. Étant donné que cette échelle est celle de nombreux mécanismes biologiques dans le corps humain, les nanoparticules (molécules à l’échelle du nanomètre) et nanomatériaux ont la capacité de franchir les barrières naturelles, d’accéder à de nouveaux sites d’administration, ou encore d’interagir avec l’ADN ou les protéines, que ce soit dans le sang ou à l’intérieur des organes, tissus et cellules. Les particules nanoscopiques sont inférieures à 100 nanomètres et ne présentent pas de toxicité contrairement aux médicaments standards.1,2
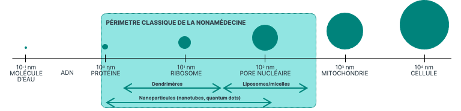
Quels sont les champs d’application de la nanomédecine ?
Au-delà de l’aspect thérapeutique, la nanomédecine va révolutionner différents domaines d’application. Du diagnostic au suivi des patients en passant par les thérapies ciblées et la médecine régénérative, la nanomédecine offre un nouveau moyen très précis d’interagir et de cibler spécifiquement un tissu, un type cellulaire ou même une molécule. Ceci est possible grâce à la modification ou à l’acquisition de certaines propriétés physicochimiques des substances ou des matériaux nanoscopiques.1,3
Voici une représentation de la répartition des essais cliniques basée sur la nanomédecine par indications cliniques en 2020 :4

Thérapeutique : nanomédicament et oncologie
L’oncologie est, de loin, le champ d’application le plus prometteur de la nouvelle médecine avec 9 médicaments déjà commercialisés dans le monde1. Une étude récente a montré que 65 % des essais cliniques dans le secteur de la médecine nanoscopique étaient consacrés aux applications dans le traitement du cancer. Au-delà du but principal qui est de réduire ou d’éradiquer le cancer, il est également important d’améliorer la qualité de vie des patients durant le traitement en limitant les effets secondaires.4

Quels sont les avantages et les limites des nano médicaments ?
Les médicaments nanoscopiques jouent un rôle crucial dans le traitement des cancers, notamment grâce à l’utilisation de nanovecteurs, capables de transporter puis de libérer le principe actif (molécules) du médicament dans les cellules cancéreuses sans endommager les cellules saines environnantes. Cependant, des limites subsistent. Par exemple, une tumeur doit être correctement vascularisée pour permettre une bonne distribution du traitement. Les nanomédicaments apportent également l’avantage d’encapsuler (nanovecteurs) le principe actif et donc de le protéger de la dégradation. De plus, de nouvelles méthodes physiques en développement permettraient d’augmenter la vitesse de délivrance du nanomédicament ainsi que la quantité libérée dans la tumeur.1,2
Focus sur les nanovecteurs 1,2,5
Les nanovecteurs sont des éléments nanoscopiques (micelle, liposome, enveloppe de polymère) capables de transporter, protéger et libérer une substance active à un endroit précis.
À ce titre, trois générations de nanovecteurs ont vu le jour :
- 1ère génération (1950-1980) : permettent de surmonter les barrières physicochimiques (solubilité aqueuse, diffusion passive, taille des molécule). Ils sont identifiés par l’organisme comme des corps étrangers. ils peuvent, par exemple, être captés par le foie et servent donc à le soigner directement.
- 2ème génération (1980-2010) : ce sont des nanoparticules recouvertes de polymères hydrophiles permettant une meilleure circulation dans le sang car moins reconnues comme un corps étranger. La technologie améliore l’efficacité de ciblage et l’administration du médicament précédemment limitées par la clairance rapide des particules par le sang, le foie ou la rate. Ces nanoparticules peuvent servir à traiter des tumeurs cancéreuses.
- 3ème génération (2010 à aujourd’hui) : ce sont des nanoparticules avec une structure complexe :
- permettant de délivrer simultanément plusieurs principes actifs,
- ou modulant la délivrance du principe actif sur un site précis (ex : vaccins à ARN messager).
Médecine régénérative : des biomatériaux nanoscopiques
La médecine restauratrice a pour but de réparer ou remplacer des tissus endommagés suite à une maladie (dysfonctionnement par anomalie génétique ou constitutionnelle) ou un traumatisme par des tissus sains et fonctionnels. Pour ce faire, la thérapie cellulaire peut faire intervenir des matériaux biocompatibles nanoscopiques : on parle de nanobiomatériaux. Ces derniers sont structurés de manière à mimer la surface d’un tissu physiologique ou alors à constituer une matrice permettant la colonisation par des cellules d’intérêt, telles que des cellules souches.3
Dans ce contexte, des implants sous-rétiniens ont été développés à partir de nanofils de dioxyde de titane revêtus de nanoparticules d’or mimant les fonctions des photorécepteurs naturels de l’œil. Après l’implantation par chirurgie, la lumière favorise l’activation du nerf optique ce qui a permis à des souris aveugles de retrouver la vue.3
Délivrer des acides nucléiques : l’essor des vaccins ARN
L’un des aspects positifs de la pandémie de la Covid-19 est qu’elle a mis sur le devant de la scène les nanomédicaments grâce au développement des vaccins à ARN messager (ARNm). En effet, leur technologie fait intervenir les nanoparticules : les ARNm sont encapsulés dans des particules lipidiques. Ces dernières les protègent de la dégradation et leur permettent d’entrer directement dans les cellules en fusionnant avec la membrane lipidique des cellules. Cette nanovectorisation des acides nucléiques est un enjeu important de la médecine faisant appel à la technologie nanoscopique et pourrait apporter de nouvelles solutions pour le développement de la thérapie génique ou encore le développement de nouvelles injections contre le cancer par exemple.2,3,6
Diagnostic : le renouveau de l’imagerie médicale
Aujourd’hui, les systèmes de l’imagerie médicale (radiographie, IRM, scintigraphie) reposent sur la visualisation d’un produit de contraste injecté dans l’organisme. Bien que les nanomolécules soient déjà présentes dans ce domaine (notamment pour les IRM où des molécules d’oxyde de fer sont utilisées pour certains examens neurologiques ou vasculaires, de nouvelles solutions permettraient d’améliorer la résolution et la spécificité des images obtenues) avec une meilleure tolérance.3
L’imagerie pourrait également devenir plus spécifique grâce, par exemple, à l’utilisation de nanoparticules photolumineuses développées pour réagir en présence de composés physiologiques (comme les espèces réactives de l’oxygène), et ainsi détecter plus spécifiquement la présence d’une inflammation ou d’une tumeur.3
Mais au-delà du diagnostic, parmi les nombreux secteurs de la médecine, un nouveau domaine pourrait se développer : la théranostique, contraction de « thérapeutique » et « diagnostique ». Cette technique permettrait de visualiser l’accumulation de nanomolécules dans une zone ciblée du corps puis de déclencher localement la libération d’un principe actif inclus dans un nanovecteur activable.1,3
Atteindre le système nerveux central
L’échelle nanoscopique permet d’accéder à des zones, comme le système nerveux central, qui sont presque inaccessibles aux thérapies actuelles. En effet, le passage de la barrière hématoencéphalique (BHE) pour le traitement des maladies neurodégénératives (maladie d’Alzheimer, etc.) reste un défi que les nouveaux traitements de la nanomédecine pourraient relever grâce à leurs propriétés physico-chimiques. Des essais précliniques sur les animaux ont montré des résultats encourageants dans ce domaine grâce au passage de nanoparticules à travers la BHE par transcytose ou endocytose. Ceci permet de délivrer plus efficacement les thérapies dans le système nerveux central.1,4
Les enjeux futurs de la médecine à taille nano
Le développement de composants nanoscopiques pour les produits pharmaceutiques ou les dispositifs médicaux offre la perspective de traitements innovants répondant à des besoins médicaux encore non satisfaits aujourd’hui.7
Les questions relatives aux risques et à l’éthique
Ces nouveaux médicaments provenant de la technologie nano posent toutefois des questions éthiques et philosophiques quant à leurs utilisations dans les années à venir. En effet, l’essor d’un tel domaine comporte des risques tant les impacts sur le vivant et l’environnement peuvent être importants. Que ce soit au niveau scientifique : Comment les contrôler qualitativement ? Comment les maîtriser sur le long terme ? Comment en mesurer l’efficacité ? Mais également au niveau sociétal : allons-nous nous diriger vers l’homme augmenté ? Quel va être l’impact sur la notion d’humanité ?
Autant de questions qui nécessitent un cadre scientifique, éthique et juridique pour maîtriser l’essor de la nanomédecine que ce soit au niveau national ou international.1,7
Les enjeux réglementaires et techniques
Comme tout autre médicament, un nanomédicament doit répondre aux mêmes critères de sécurité, d’efficacité et de qualité pharmaceutique pour être mis sur le marché.
Cependant, en raison de leur complexité, un certain nombre de défis scientifiques et réglementaires sont à relever. Notamment, la nécessité de développer et de normaliser de nouvelles méthodes d’essai et de compréhension du comportement in vivo.7
Dans ce contexte, l’Agence Européenne du Médicament (EMA) propose de mettre en œuvre les actions suivantes afin de partager les connaissances et d’harmoniser les pratiques réglementaires :7
- établir des règles concernant les exigences en matière de pharmacocinétique et de pharmacodynamique, ainsi que l’efficacité et la sécurité à long terme ;
- développer et normaliser de nouvelles méthodes d’essai liées à l’évaluation de la qualité et de la sécurité des médicaments faisant appel à la technologie nano ;
- comprendre la qualité pharmaceutique d’un produit donné ainsi que la relation entre celui-ci, son activité biologique et son comportement in vivo.
Dans le même sens, la France doit établir un cadre pour répondre aux exigences de l’Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM) à l’aide de groupes de collaboration mettant en contact les chercheurs et les industriels afin de construire le futur de cette solution innovante.1
Définition :
Nanovecteur : les nanovecteurs sont des protections contre les enzyme du corps pour les particules nanométriques.
(1) Les entreprises du médicament (LEEM). Innovation et santé : la nanomédecine. Santé 2030. Disponible sur : https://www.leem.org/la-nanomedecine [consulté le 28/10/2022]
(2) Laboratoire national de métrologie et d’essais (LNE). Nanomédecine : en route vers la médecine du futur. Disponible sur : https://www.lne.fr/fr/on-en-parle/nanomedecine [consulté le 28/10/2022]
(3) Inserm, la science pour la santé. Nanotechnologies : un nouveau pan la médecine. 30/08/2022. Disponible sur : https://www.inserm.fr/dossier/nanotechnologies/
(4) Germain M., et al. Delivering the power of nanomedecine to patients today. Journal of Controlled Release. 2020
(5) Williams DS., et al. Controlling the morphology of copolymeric vectors for next generation nanomedicine. Journal of Controlled Released. 2017
(6) Inserm, la science pour la santé. Thérapies à ARN : un domaine thérapeutique en pleine expansion. 28/01/2022. Disponible sur : https://www.inserm.fr/dossier/therapies-a-arn/ [consulté le 28/10/2022]
(7) European Medecines Agency (EMA). Regulatory Science to 2025 – Strategic Reflection. Disponible sur : https://www.ema.europa.eu/en/about-us/how-we-work/regulatory-science-strategy [consulté le 28/10/2022]