Etude Aspect cUTI chez l’adulte
Étude ASPECT-cUTI (1,3,4) chez l’adulte
Évaluation de ZERBAXA® dans les infections des voies urinaires compliquées chez l’adulte (1,4,8)
Objectif de l’étude (4,8)
Évaluation de l’efficacité et de la tolérance de ZERBAXA® versus lévofloxacine chez l’adulte atteint d’une infection des voies urinaires compliquée ou d’une pyélonéphrite.
Descriptif de l’étude (4,8)
Étude de non-infériorité, multicentrique, en double aveugle, randomisée.

Limites des données cliniques (1,4)
Les patients immunodéprimés et les patients présentant une neutropénie sévère ont été exclus des études cliniques.
- 18,2 % (126/693) des patients microbiologiquement évaluables avaient une infection compliquée des voies urinaires basses.
- 30 % des germes à Gram négatif et 57 % des germes à Gram positif étaient résistants à la lévofloxacine.
- Très peu d’entérobactéries productrices de bêta-lactamase à spectre étendu.
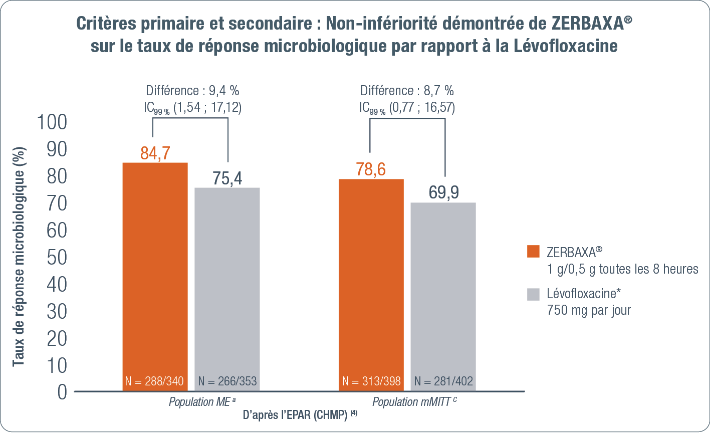
Critère primaire (4)
Taux de réponse microbiologique dans la population ME a à la visite TOC. b
(Objectif : démontrer la non-infériorité de ZERBAXA® versus lévofloxacine en utilisant une marge de non infériorité de 10 % avec un seuil de significativité au test unilatéral de 0,005).
# La dose était ajustée en cas d’insuffisance rénale modérée et le traitement arrêté si la clairance de la créatinine baissait en dessous de 30 mL/min. (4)
* Les recommandations sur la posologie de Tavanic® sont les suivantes (posologie chez les patients avec une fonction rénale normale, clairance de la créatinine > 50 mL/min) :
– Pyélonéphrites : 500 mg une fois par jour pendant 7 à 10 jours.
– Infections urinaires compliquées : 500 mg une fois par jour pendant 7 à 14 jours. [VIDAL]
** Jusqu’à 9 jours en cas de sonde vésicale à demeure, de mise en place récente de stomie urinaire ou de traitement pour une obstruction des voies urinaires. (4)
IV : Intraveineux
Critère secondaire (4)
Taux de réponse microbiologique dans la population mMITT c à la visite TOC. b
(objectif : démontrer la non-infériorité de ZERBAXA® versus lévofloxacine en utilisant un seuil de significativité au test unilatéral de 0,005).
Analyse statistique (4)
La non-infériorité de ZERBAXA® est statistiquement démontrée si la borne inférieure de l’intervalle de confiance bilatéral à 99 % est supérieure à -10 %.
Place dans la stratégie thérapeutique chez l’adulte (3)
Dans les indications de l’AMM, il est recommandé de ne pas utiliser l’association ceftolozane/tazobactam comme alternative aux carbapénèmes pour le traitement des entérobactéries résistantes aux C3G.
ZERBAXA® (ceftolozane/tazobactam) est un traitement de dernier recours réservé aux patients atteints d’infections à P. aeruginosa sensibles au ceftolozane/tazobactam et pour lesquels le recours aux autres bêta lactamines et/ou aux carbapénèmes (méropénème ou imipénème-cilastatine) n’est pas envisageable en cas de résistance.
Afin de préserver ZERBAXA® , il est nécessaire de restreindre exclusivement son utilisation en dernier recours, la décision thérapeutique doit être prise avec l’aide d’un référent antibiotique, avec réévaluation systématique au bout de 48h après le début du traitement.
Éradication microbienne : tous les pathogènes infectieux initiaux à un niveau < 103 CFU/mL. (4)
a Population Microbiologically Evaluable : Patients ayant reçu au moins une dose de traitement, ayant suivi le protocole de l’étude, ayant effectué la visite TOC dans le temps imparti, ayant eu un résultat et ayant un ECBU interprétable à la visite TOC. (4)
b Visite Test-Of-Cure : 7 jours (+/-2 jours) après la dernière dose de traitement administrée.
c Population microbiological Modified Intent-To-Treat : patients ayant reçu au moins une dose de traitement
et qui présentent au moins un germe uropathogène identifié à l’ECBU pré-traitement. (4)
ECBU : Examen Cytobactériologique des Urines ; TOC : Test-Of-Cure.
Taux de réponse microbiologique selon le pathogène à l’inclusion chez l’adulte (population ME*)(4)
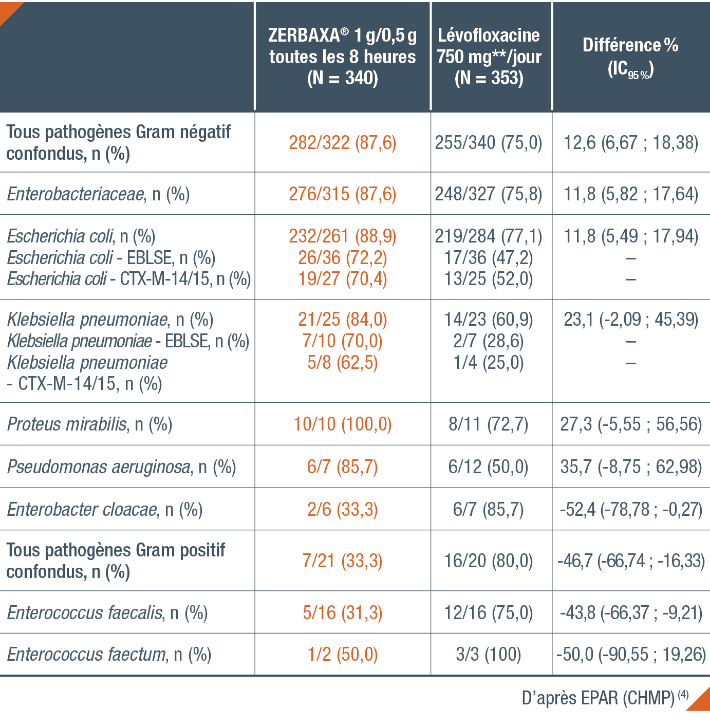
* Population Microbiologically Evaluable : Patients ayant reçu au moins une dose de traitement, ayant respecté le protocole de l’étude, ayant effectué la visite TOC dans le temps imparti, ayant eu un résultat et ayant un ECBU interprétable à la visite TOC. (4)
** Les recommandations sur la posologie de Tavanic® sont les suivantes (posologie chez les patients avec une fonction rénale normale, clairance de la créatinine > 50 mL/min) : pyélonéphrites : 500 mg une fois par jour pendant 7 à 10 jours ; infections urinaires compliquées : 500 mg une fois par jour pendant 7 à 14 jours. [VIDAL]
EBLSE : Entérobactérie productrice de bêta-lactamase à spectre étendu ; ECBU : Examen Cytobactériologique des Urines ; TOC : Test-Of-Cure.
Tolérance de ZERBAXA® dans l’étude ASPECT-cUTI chez l’adulte (4)
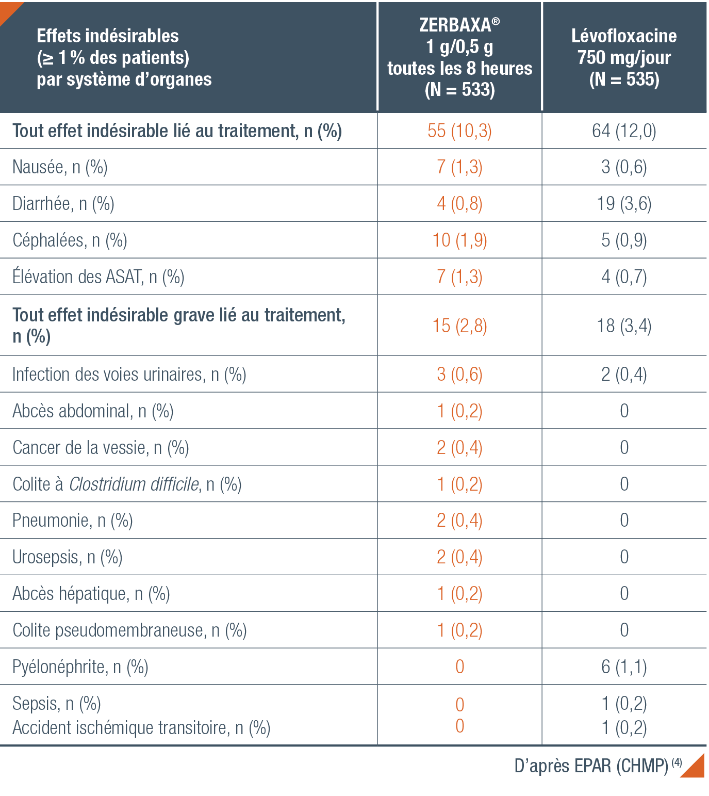
Pour plus d’informations sur les effets indésirables de ZERBAXA®, se rapporter à la Tolérance Générale.
ASAT : Asparate Aminotransférase.
Diérence entre la FDA et l’EMA dans le modèle de l’étude ASPECT-cUTI (4,8)

(1) Résumé des Caractéristiques du produit ZERBAXA®.
(3) EMA – Committee for Medicinal Products for Human Use (CHMP) – assessment report ZERBAXA®. 25 July 2019 – EMA/463294/2019.
(4) Marin H Kollef, et al. ce olozane-tazobactam versus meropenem for treatment of nosocomial pneumonia (ASPECT-NP): a randomised, controlled, double-blind, phase 3, non-inferiority trial. Lancet Infect Dis 2019.
(8) Wagenlenher FM, et al. Ceftolozane-tazobactam compared with levofloxacinin the treatment of complicated urinary-tract infections, including pyelonephritis : a randomised, double-blind, phase 3 trial (ASPECT-cUTI). Lancet 2015;385;1949-56

