Etude Aspect cIAI chez l’adulte
ÉTUDE ASPECT cIAI (1,3,4,9) CHEZ L’ADULTE
Évaluation de ZERBAXA® dans les infections intra-abdominales compliquées
chez l’adulte(1,4,9)
Objectif de l’étude (9)
Évaluation de l’efficacité et de la tolérance de ZERBAXA® en association au métronidazole versus méropénème
pendant 14 jours chez l’adulte atteint d’une infection intra-abdominale compliquée.
Descriptif de l’étude (9)
Étude de non-infériorité, multicentrique, prospective, randomisée, en double aveugle versus méropénème.

Limites des données cliniques (1,4)
- Le diagnostic le plus fréquent était une perforation appendiculaire ou un abcès péri-appendiculaire (420/970 [43,3 %] patients), dont 137/420 (32,6 %) avaient initialement une péritonite diffuse.
- Environ 82 % de tous les patients dans l’essai avaient un score APACHE II < 10 et 2,3 % avaient initialement une bactériémie.
- Le taux de guérison était beaucoup plus bas pour les infections d’origine colique que pour celle d’origine appendiculaire. Les résultats ont été moins bons chez les patients ayant une infection sévère.
Analyse de sous-groupe selon les caractéristiques initiales sélectionnées : réponse clinique à la visite TOC (population ITT)
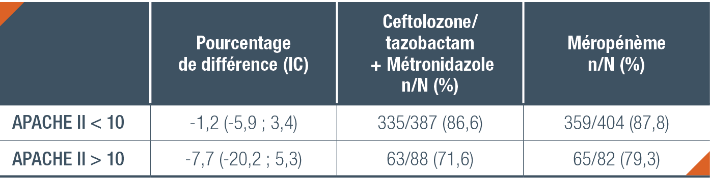
IV : Intraveineux ; APACHE : Acute Physiology and Chronic Health Evaluation.
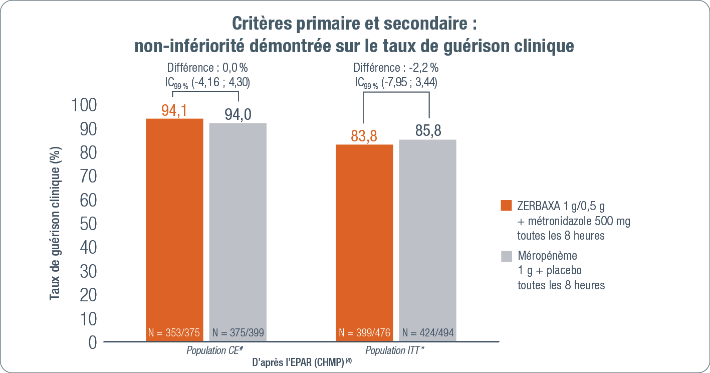
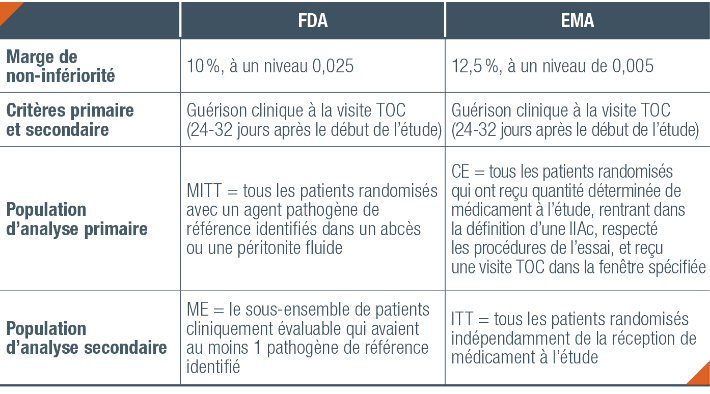
Critère primaire (4)
Taux de guérison clinique dans la population CE# à la visite TOC## basé sur la différence du taux de réponse clinique
entre les deux traitements en utilisant une marge de non-infériorité de 12,5 % avec un seuil de significativité au
test unilatéral de 0,005.
Critère secondaire (4)
Taux de guérison clinique dans la population ITT* à la visite TOC## basé sur la différence du taux de réponse
clinique entre les deux traitements en utilisant une marge de non-infériorité de 12,5 % avec un seuil de
significativité au test unilatéral de 0,005.
Analyse statistique (4)
La non-infériorité de ZERBAXA® est statistiquement démontrée si la borne inférieure de l’intervalle de confiance
bilatéral à 99 % est supérieure à -12,5 %.
Place dans la stratégie thérapeutique chez l’adulte (3)
Dans les indications de l’AMM, il est recommandé de ne pas utiliser l’association ceftolozane/tazobactam comme
alternative aux carbapénèmes pour le traitement des entérobactéries résistantes aux C3G.
ZERBAXA® (ceftolozane/tazobactam) est un traitement de dernier recours réservé aux patients atteints
d’infections à P. aeruginosa sensibles au ceftolozane/tazobactam et pour lesquels le recours aux autres bêta
lactamines et/ou aux carbapénèmes (méropénème ou imipénème-cilastatine) n’est pas envisageable en cas de
résistance.
Afin de préserver ZERBAXA®, il est nécessaire de restreindre exclusivement son utilisation en dernier recours, la
décision thérapeutique doit être prise avec l’aide d’un référent antibiotique, avec réévaluation systématique au
bout de 48h après le début du traitement.
# Population Clinically Evaluable : sous-groupe de la population en ITT* ayant reçu le bon nombre de doses de traitement, présentant une infection intra-abdominale compliquée telle que définie par le protocole de l’étude, ayant suivi le protocole de l’étude et ayant effectue la visite TOC dans le temps imparti.(4)
## Visite Test-Of-Cure : 24 à 32 jours après le début de l’administration du traitement.(4)
* Population Intent-To-Treat : tous les patients randomisés ayant ou non reçu le traitement (regroupés selon le traitement auquel ils étaient randomisés).(4)
Taux de réponse microbiologique selon le pathogène à l’inclusion chez l’adulte (population ME*) (4)
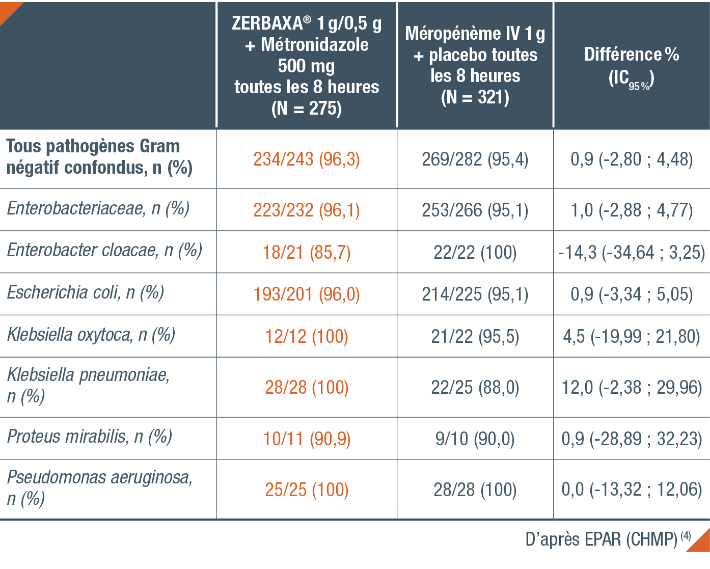
* Population Microbiologically Evaluable : patients de la population CE ayant au moins un pathogène sensible à ZERBAXA® à l’inclusion identifié.(4)
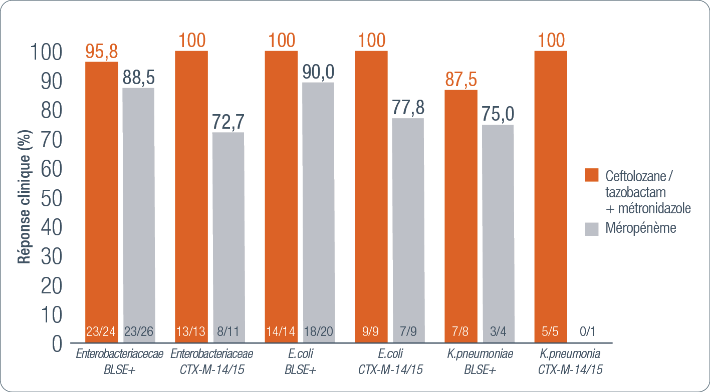
Taux de réponse clinique dans la population cliniquement évaluable selon le pathogène à l’inclusion à la visite TOC chez l’adulte(9)
La majorité des BLSE productrices de CTX-M 14/15 exprimaient également un ou plusieurs enzymes suivants :
OXA-1/30, TEM-1, SHV-1, SHV-11, SHV-32.
Le ceftolozane est un antimicrobien de la classe des céphalosporines. Le ceftolozane exerce une activité bactéricide
en se liant à d’importantes protéines de liaison aux pénicillines (PLP), entraînant l’inhibition de la synthèse de la
paroi cellulaire bactérienne et ainsi la mort cellulaire. (4)
Le tazobactam est une bêta-lactamine structurellement apparentée aux pénicillines. C’est un inhibiteur de
nombreuses bêta-lactamases de Classe A Moléculaire, incluant les enzymes CTX-M, SHV, et TEM et de certaines
ß-lactamases de Classe C (céphalosporinase). (4)
Le tazobactam n’inhibe pas toutes les enzymes de classe A. (1)
Le tazobactam n’inhibe pas les types de bêta-lactamases suivants :(1)
- les enzymes AmpC (produites par Enterobacteriaceae),
- les sérines carbapenemases (par exemple, les carbapenemases de Klebsiella pneumoniae [KPCs]),
- les metallo-bêta-lactamases (par exemple, la New Delhi metallo-bêta-lactamase [NDM]),
- les bêta-lactamases de la classe D de Ambler (OXA-carbapenemases).
BLSE : bêta-lactamase à spectre étendu.
Tolérance de ZERBAXA® chez l’adulte dans l’étude ASPECT-cIAI (4)
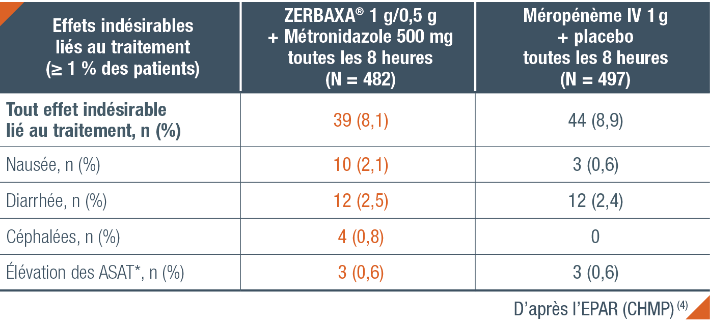
Pour plus d’informations sur les effets indésirables de ZERBAXA®, se rapporter à la Tolérance Générale.
* ASAT : Aspartate Aminotransférase.
Tolérance de ZERBAXA® chez l’adulte dans l’étude ASPECT-cIAI (4)
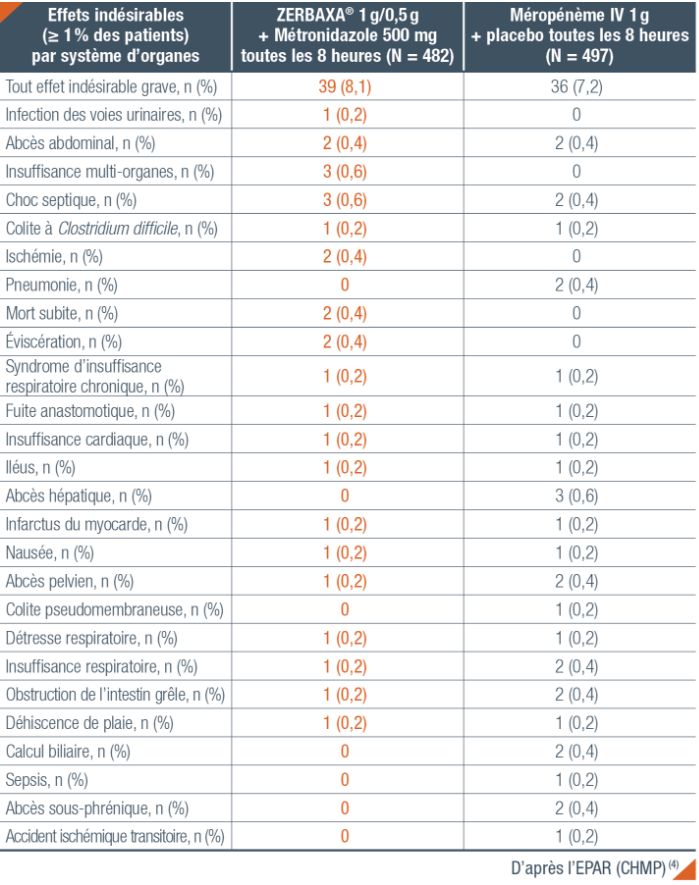
Pour plus d’informations sur les effets indésirables de ZERBAXA®, se rapporter à la Tolérance Générale.
Effets indésirables sévères/décès/autres effets indésirables SIGNIFICATIFS CHEZ L’ADULTE (4, 10)
Décès
Dans cette étude de phase III, on a observé 12 décès dans le groupe ZERBAXA® et 8 décès dans le groupe
comparateur. La plupart (11 versus 8) ont eu lieu pendant l’étude ASPECT cIAI. Sept patients sont décédés sous
traitement ou dans les 24h après la fin du traitement. Aucun n’a été considéré comme lié au traitement. Les causes
de décès dans le groupe ZERBAXA® ont été : pneumonie, insuffisance multi-organes (3), insuffisance rénale
obstructive, insuffisance cardiaque (2), infarctus du myocarde et mort subite (2).
Dans le groupe méropénème, les causes de décès ont été : infection (greffe de peau suivant une amputation de la
jambe), collapsus circulatoire, accident de la route, choc septique (2), embolie pulmonaire, insuffisance cardiaque
et infarctus du myocarde.
Effets indésirables sévères
L’incidence des effets indésirables sévères a été plus importante dans les infections intra-abdominales
compliquées. Au sein des études, il n’y a pas eu de différence importante entre les traitements. Dans l’étude
ASPECT cUTI, l’infection digestive à C. difficile et la colite pseudomembraneuse ont été considérées comme liées
au traitement. Dans l’étude ASPECT cIAI, 10 effets indésirables sévères dans le groupe ZERBAXA® et 12 dans
le groupe méropénème ont été associés à une réponse clinique défavorable et deux cas (un par groupe) d’infection
digestive à C. difficile ont été considérés comme liés au traitement.
Données biologiques
- Hépatique
Dans les études de phase III, des variations hématologiques de grade 2 ou plus par rapport à l’inclusion ont été
observées pour 11 % des patients dans le groupe ZERBAXA® et 8 % dans le groupe comparateur. Deux patients
dans le groupe ZERBAXA® ont eu une séroconversion du test de Coombs à la visite de fin de traitement sans
preuve d’anémie hémolytique.
Dans l’étude ASPECT cIAI, des variations vers les grades 3 et 4 ont été fréquemment observés pour le taux de γGT
(9 % pour ZERBAXA® versus 13 % pour méropénème), une diminution de la phosphatémie (4 % versus 7 %) et une
élévation des ASAT (3 % versus 2 %).
L’incidence de l’élévation des enzymes hépatiques > 3 x LSN dans l’étude ASPECT cIAI a été de 2 % dans le groupe
ZERBAXA® versus < 1 % dans le groupe méropénème. Un sujet dans le groupe ZERBAXA® a rempli les critères de
la règle de Hy* le 3ème jour de l’étude mais a aussi rempli les critères de dépistage pendant l’étude.
- Rénale
Dans les études de phase III, le détail des effets indésirables sévères a révélé que 11 (1,1 %) patients du groupe
ZERBAXA® et 8 (0,8 %) patients dans les groupes comparateurs ont eu une insuffisance rénale sévère, mais une
seule dans chaque groupe a été considérée comme liée au traitement. Une insuffisance rénale a été rapportée chez
6 versus 3 patients et une insuffisance rénale sévère chez 4 versus 1 patient dans les différents groupes. À la visite
TOC, les données indiquent que 15 patients avec une valeur normale à l’inclusion avaient une élévation de grade 1, 2
ou 4 et 2 avaient une élévation du grade 1 au grade 2. Dans les groupes comparateurs, 19 patients ont eu une
élévation d’un niveau normal à l’inclusion à un grade 1 (16) ou à un grade 2 (3) à la visite TOC.
Niveau de créatinine selon le grade
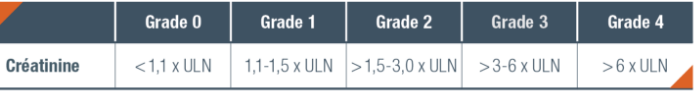
Pour plus d’informations sur les effets indésirables de ZERBAXA®, se rapporter à la Tolérance Générale.
Loi de Hy (10)
La Loi de Hy est utilisée comme un indicateur de lésion hépatique d’origine médicamenteuse potentielle. Les trois
composants suivants doivent être présents pour être considéré comme un cas potentiel de la « Loi de Hy » :
- Élévation des aminotransférases, par ex., taux d’ALAT et d’ASAT > 3 x LSN.
- Taux d’AP < 2 x LSN.
- Augmentation du taux de bilirubine totale ≥ 2 x LSN.
LSN : Limite supérieure à la normale ; TOC : Test-Of-Cure.
* http://www.meddra.org/sites/default/files/guidance/file/intguide_14_1_french.pdf
Différence d’évaluation entre FDA et EMA (4,8,9)
Différence entre la FDA et l’EMA dans le modèle de l’étude ASPECT-cIAI (4,9)
(1)Résumé des Caractéristiques du produit ZERBAXA®.
(3)EMA – Committee for Medicinal Products for Human Use (CHMP) – assessment report ZERBAXA®. 25 July 2019 – EMA/463294/2019.
(4)Marin H Kollef, et al. ce olozane-tazobactam versus meropenem for treatment of nosocomial pneumonia (ASPECT-NP): a randomised, controlled, double-blind,
phase 3, non-inferiority trial. Lancet Infect Dis 2019.
(9)Clinical Study Report (CSR) PM008MK7625A, table 10-4, 11.1.4.2.3, table 12-2.

