Existe-t-il un avenir pour la détection des cellules tumorales circulantes en oncologie thoracique ?
© Edimark – Correspondances en Onco-Théranostic, Vol XIII – n° 4
L’utilisation d’une biopsie liquide d’origine sanguine en oncologie thoracique, principalement dans la prise en charge des patients atteints d’un cancer bronchopulmonaire non à petites cellules (CBNPC) de type non épidermoïde et de stade avancé ou métastatique, fait partie de nos jours du standard de prise en charge 1. Toutefois, cette utilisation se fait dans le cadre de recommandations internationales et à partir de l’ADN libre circulant isolé du plasma 1. Ainsi, une biopsie liquide peut être réalisée au moment du diagnostic ou à progression tumorale, en l’absence de biopsie tissulaire tumorale ou si cette biopsie n’est pas contributive pour le diagnostic morphologique et moléculaire 1. Les tests moléculaires effectués à partir de l’ADN libre circulant permettent de détecter des altérations génomiques qui peuvent être accessibles à une thérapeutique ciblée. À progression tumorale, grâce à cette approche, il est possible d’identifier des altérations génomiques de résistance permettant parfois de modifier cette thérapie ciblée.
Hormis l’ADN libre circulant dans le plasma, une biopsie liquide réalisée chez un patient atteint d’un cancer du poumon non à petites cellules ou à petites cellules peut permettre d’identifier et de caractériser d’autres composés sanguins, en particulier des cellules tumorales circulantes (CTC), des vésicules extracellulaires (notamment des exosomes), des ARN libres (comme les micro-ARN) et des protéines plasmatiques 2. Les CTC peuvent alors représenter un biomarqueur pronostique ou prédictif d’une réponse thérapeutique. À l’inverse de l’ADN libre circulant dans le plasma, les CTC et les biomarqueurs associés à ces autres composés ne sont pas, à ce jour, utilisées en routine clinique. Les contraintes technologiques, les critères insuffisants concernant la spécificité et la sensibilité des tests utilisés, les difficultés de reproductibilité des résultats et de validation intra/inter-laboratoire(s), le coût et le peu d’études cliniques associées aux CTC, représentent des facteurs limitants.
Une des questions est de savoir si, malgré des résultats prometteurs, l’un ou plusieurs de ces composés seront utilisés ou non à l’avenir en pratique clinique en oncologie thoracique.
Une des perspectives est également de renforcer les paramètres de sensibilité et de spécificité des biopsies liquides en développant des approches de « biologie intégrative » combinant, en une analyse et en un seul temps, plusieurs composés circulants comme l’ADN libre circulant, les CTC, voire en y associant aussi les exosomes.
Mots clés : Cellules tumorales circulantes – Cancer du poumon – Biologie moléculaire – Thérapie ciblée – Immunothérapie
CTC et diagnostic, pronostic et prédiction de réponse thérapeutique
La mise en évidence des CTC chez les patients atteints d’un cancer pulmonaire a été réalisée dans différentes indications. Ainsi, des CTC peuvent être identifiées chez des patients atteints d’un cancer du poumon de stade avancé ou métastatique, mais aussi dans les stades précoces, en particulier avant l’intervention chirurgicale 3,4. Une association entre la présence de CTC et une progression tumorale d’un stade avancé ainsi qu’une récidive tumorale chez certains patients opérés d’un CBNPC ont été ainsi observées 3. Ces cellules tumorales sont en nombre très faible comparativement à l’ensemble des cellules hématologiques et circulent, soit de façon isolée [Figure 1], soit à plusieurs [Figure 2], mais sans contact entre elles, soit sous la forme d’amas ou de « clusters », appelés microthrombi tumoraux [Figure 3], ces derniers ayant alors un potentiel invasif plus important 3. Dans ces amas, les CTC interagissent avec les polynucléaires neutrophiles, les monocytes, les lymphocytes et/ou les plaquettes qui constituent ainsi un microenvironnement circulant 5. Des biomarqueurs prédictifs d’une réponse thérapeutique comme une mutation de l’EGFR, un réarrangement d’ALK ou de ROS1, ou d’une résistance à des thérapies ciblées, peuvent être identifiés à partir des CTC 6-8. Dans les traitements par immunothérapies, en particulier ciblant PD-L1, la mise en évidence de la protéine PD-L1 à la surface des CTC a été réalisée dans différentes études 9-11. La possibilité de suivre l’évolution des CTC exprimant PD-L1 sous immunothérapie ou l’utilisation de cette approche comme biomarqueur prédictif de la réponse thérapeutique ont été envisagées à la suite de ces études, mais cela n’a pas été transféré en pratique clinique 12. La recherche au niveau des CTC de l’expression membranaire et/ou cytoplasmique d’autres protéines ciblant des anticorps drogue-conjugués, en particulier c-MET, TROP2, HER2, HER3, CEACAM5, B7-H3, est possible 13.
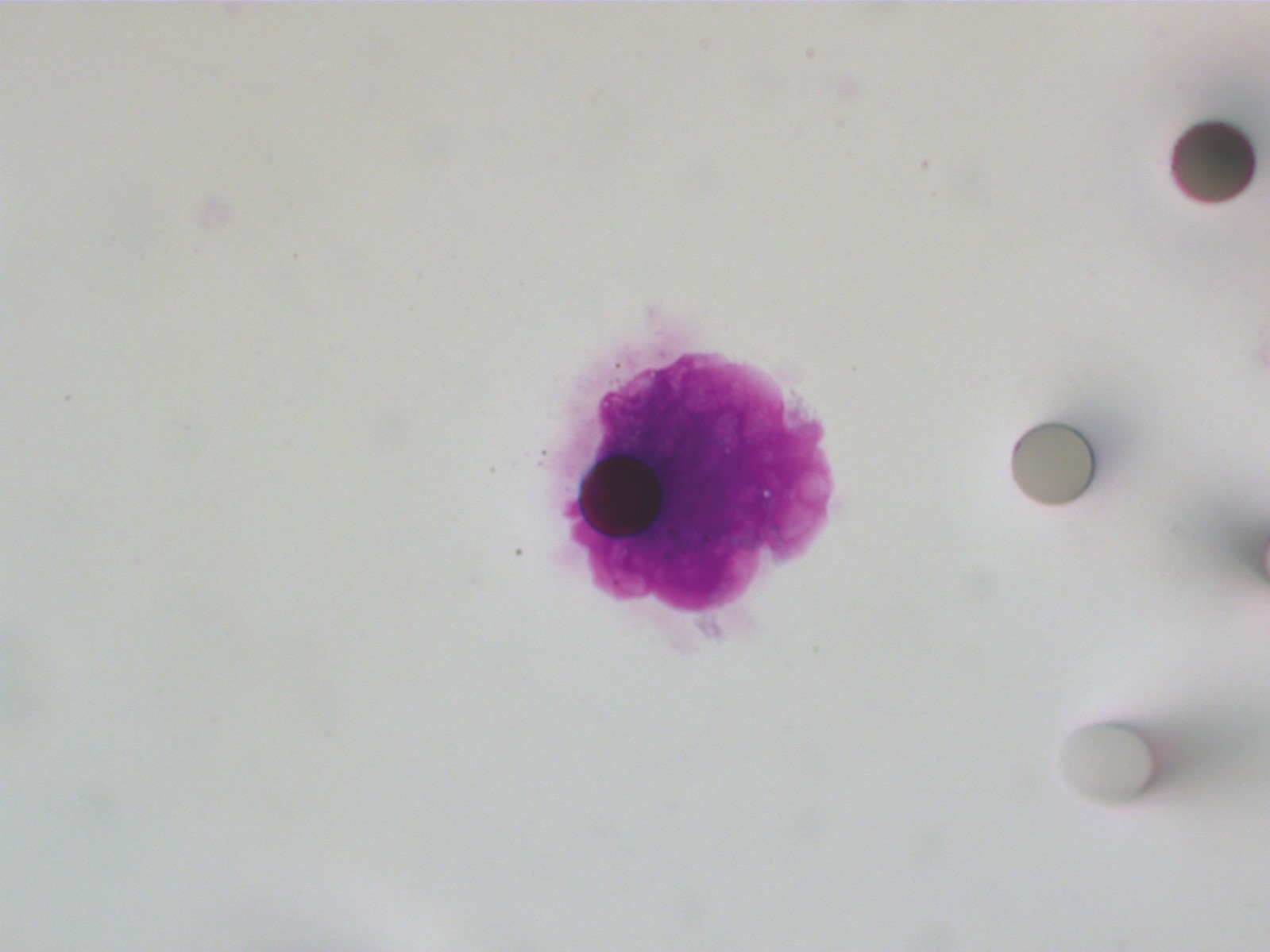
[Figure 1]
Cellule tumorale circulante isolée en utilisant une méthode directe de filtration sanguine (coloration par le Giemsa, × 800), chez un patient atteint d’un cancer pulmonaire non à petites cellules de stade II.
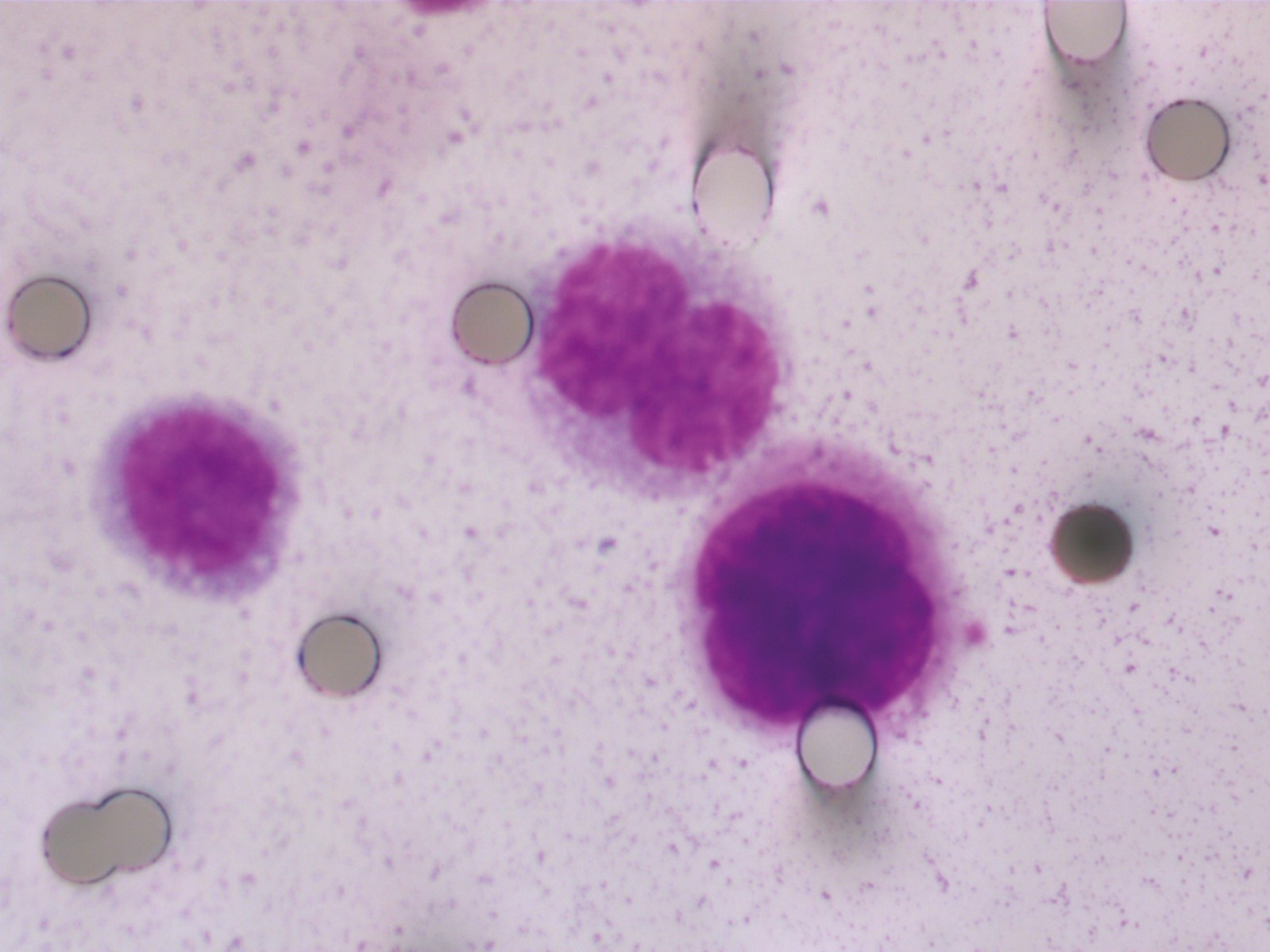
[Figure 2]
Cellules tumorales circulantes sans contact, isolées en utilisant une méthode directe de filtration sanguine (coloration par le Giemsa, × 800), chez un patient atteint d’un cancer pulmonaire non à petites cellules de stade I.

[Figure 3]
Amas de cellules tumorales circulantes (ou microthrombus tumoral), isolées en utilisant une méthode directe de filtration sanguine (coloration par le Giemsa, × 800), chez une patiente atteinte d’un cancer pulmonaire non à petites cellules de stade IV.
Certaines analyses ont montré que des CTC pouvaient être isolées très tôt chez certains patients atteints d’un CBNPC de stade I, voire chez des patients atteints d’une bronchopneumopathie chronique obstructive sans image tumorale identifiable sur l’examen tomodensitométrique 14. De nombreuses CTC peuvent être isolées et caractérisées également dans les cancers pulmonaires à petites cellules. Des modèles expérimentaux ont été possibles à partir de ces CTC pour mieux les caractériser sur les plans phénotypique et génomique, en ayant aussi la possibilité d’injecter ces cellules chez la souris et de faire développer des modèles de tumeurs injectées par voie sous-cutanée 15, 16.
Avantages et limites de l’utilisation des cellules tumorales circulantes comme biomarqueurs dans les cancers pulmonaires
Compte tenu des données très prometteuses obtenues à partir de la recherche et de la caractérisation des CTC chez les patients atteints d’un cancer pulmonaire, il serait intéressant de comprendre pourquoi ce type d’approche n’est pas utilisé en pratique quotidienne actuellement et que seule la caractérisation moléculaire réalisée à partir de l’ADN libre plasmatique est possible en routine. En effet, comparativement aux autres biomarqueurs sanguins, les CTC constituent le véritable reflet du potentiel métastatique d’un cancer pulmonaire et permettent de définir les profils génomique et protéique des cellules tumorales qui peuvent être invasives 17. Plusieurs paramètres sont à prendre en considération concernant les limites d’utilisation des CTC comme biomarqueurs en pratique quotidienne. Un des paramètres importants est associé à la méthodologie permettant la détection. Ainsi, de nombreuses méthodes sont possibles, reposant sur des techniques directes ou indirectes 18. Ces techniques utilisent des propriétés physiques de taille ou de densité ou sont liées aux caractéristiques antigéniques des CTC 18. Aucune de ces méthodes n’a été validée par la Food and Drug Administration aux États-Unis pour les patients atteints d’un cancer pulmonaire. La complexité de ces méthodes, la maîtrise de la phase pré-analytique, la difficulté de reproduire les résultats, les variations de sensibilité et de spécificité des tests, leur coût éventuel, l’absence de mise en place d’un remboursement des actes par les systèmes de soins au niveau national font que le choix d’une technique par rapport à une autre n’a pas permis une validation et un transfert de la recherche translationnelle à la pratique clinique 18, 19.
Perspectives
Malgré le déploiement massif des approches de RT-PCR, de PCR digitale et surtout de next-generation sequencing (NGS) à partir des biopsies liquides et des acides nucléiques plasmatiques libres circulants, la place des CTC en oncologie thoracique reste restreinte à des projets de recherche translationnelle. Faut-il ainsi considérer que ce type de biomarqueur n’a pas sa place à l’avenir dans l’offre de soins des patients atteints d’un cancer du poumon ? Plusieurs pistes d’optimisation peuvent cependant s’envisager et permettre d’intégrer les CTC au même titre que l’ADN libre circulant. L’optimisation de la technologie est incontournable et pourrait permettre une utilisation en routine. Cela passe par une automatisation des phases pré-analytique et analytique, une excellente spécificité et sensibilité de la méthode envisagée, des coûts maîtrisés et la confirmation de la valeur pronostique de cette détection ou la possibilité de mettre en évidence des biomarqueurs prédictifs d’une réponse aux thérapies ciblées, à l’immunothérapie ou aux anticorps drogue-conjugués. Une des difficultés est certainement de parvenir à combiner à la fois la détection et la caractérisation génétique des CTC en utilisant des approches de « single cell », en considérant le plus souvent la faible quantité de matériel biologique recueillie pour faire ces analyses. La mise en culture des CTC pourrait apporter une solution possible, mais cette culture est, à ce jour, plus aisée lorsqu’elle est réalisée à partir de cellules isolées d’un cancer pulmonaire à petites cellules que d’un CBNPC. Une des perspectives est peut-être de combiner les approches méthodologiques sur plusieurs composés sanguins circulants, en combinant, par exemple, la détection de l’ADN circulant et les CTC ou la détection des exosomes et des CTC. Bien que séduisante dans l’objectif d’optimiser les approches pronostiques et prédictives, cette stratégie est confrontée à plusieurs problématiques, à la fois d’ordre technologique, de délai de rendu des résultats en cas de transfert dans le domaine clinique, de coût et de remboursement, de possibilités de décentralisation dans les établissements de santé, et de validation inter-laboratoire. Seule la possibilité de réaliser des études multicentriques et des essais cliniques associant l’identification des CTC, la réponse thérapeutique, la survie sans progression et la survie globale des patients pourrait permettre d’utiliser à l’avenir les CTC comme biomarqueurs en pratique quotidienne.
(1) Malapelle U et al. The evolving role of liquid biopsy in lung cancer. Lung Cancer 2022:172:53-64.
(2) Alix-Panabières C, Pantel K. Liquid biopsy: from discovery to clinical application. Cancer Discov 2021;11(4):858-73.
(3) Hofman V et al. Preoperative circulating tumor cell detection using the isolation by size of epithelial tumor cell method for patients with lung cancer is a new prognostic biomarker. Clin Cancer Res 2011;17(4):827-35.
(4) Wankhede D et al. Circulating tumor cells as a predictive biomarker in resectable lung cancer: a systematic review and meta-analysis. Cancers (Basel) 2022;14(24):6112.
(5) Heeke S et al. Never travel alone: the crosstalk of circulating tumor cells and the blood microenvironment. Cells 2019;8(7):714.
(6) Ilié M et al. Prospective multicenter validation of the detection of ALK rearrangements of circulating tumor cells for noninvasive longitudinal management of patients with advanced NSCLC. J Thorac Oncol 2021;16(5):807-16.
(7) Pailler E et al. High level of chromosomal instability in circulating tumor cells of ROS1-rearranged non-small-cell lung cancer. Ann Oncol 2015;26(7):1408-15.
(8) Pailler E et al. Acquired resistance mutations to ALK inhibitors identified by single circulating tumor cell sequencing in ALK-rearranged non-small-cell lung cancer. Clin Cancer Res 2019;25(22):6671-82.
(9) Abdo M et al. Comparative evaluation of PD-L1 expression in cytology imprints, circulating tumour cells and tumour tissue in non-small cell lung cancer patients. Mol Oncol 2023;17(5):737-46.
(10) Eslami-S Z et al. Circulating tumour cells and PD-L1-positive small extracellular vesicles: the liquid biopsy combination for prognostic information in patients with metastatic non-small cell lung cancer. Br J Cancer 2024;130(1):63-72.
(11) Ilié M et al. Detection of PD-L1 in circulating tumor cells and white blood cells from patients with advanced non-small-cell lung cancer. Ann Oncol 2018;29(1):193-9.
(12) Hofman P et al. Liquid biopsy in the era of immuno-oncology: is it ready for prime-time use for cancer patients? Ann Oncol 2019;30(9):1448-59.
(13) Ilié M et al. Expression of MET in circulating tumor cells correlates with expression in tumor tissue from advanced-stage lung cancer patients. Oncotarget 2017;8(16):26112-21.
(14) Marquette CH et al. Circulating tumour cells as a potential biomarker for lung cancer screening: a prospective cohort study. Lancet Respir Med 2020;8(7):709-16.
(15) Hodgkinson CL et al. Tumorigenicity and genetic profiling of circulating tumor cells in small-cell lung cancer. Nat Med 2014;20(8):897-903.
(16) Shrestha P et al. Circulating tumor cells: advancing personalized therapy in small cell lung cancer patients. Mol Oncol 2024. doi: 10.1002/1878-0261.13696. Online ahead of print.
(17) Hofman V et al. Circulating tumor cell detection in lung cancer: but to what end? Cancers (Basel) 2019;11(2):262.
(18) Hofman V et al. Detection of circulating tumor cells from lung cancer patients in the era of targeted therapy: promises, drawbacks and pitfalls. Curr Mol Med 2014;14(4):440-56.
(19) Ilié M et al. Use of circulating tumor cells in prospective clinical trials for NSCLC patients – standardization of the pre-analytical conditions. Clin Chem Lab Med 2018;56(6):980-9.